Znanstvenici Sveučilišta Oxford i Tehnološkog sveučilišta Nanyang u Singapuru u suradnji s još znanstvenih institucija objavili su u znanstvenom časopisu Cell važnu studiju o liječenju raka. Studija u kojoj su sudjelovali hrvatski znanstvenici sa spomenutih sveučilišta u Singapuru, Oxfordu ali i s Instituta Ruđer Bošković iz Zagreba predstavlja novi stanični proces popravka DNK koji se naziva nukleofagija. Riječ je o vrsti autofagije, staničnog mehanizma čišćenja, procesa koji pomaže stanicama ukloniti štetne nakupine DNK-proteina, također poznate kao lezije DNK, iz njihove jezgre, osiguravajući stabilnost njihovog genetskog materijala i potiče preživljavanje stanica. Kada lijekovi za kemoterapiju uzrokuju stvaranje ovih štetnih nakupina, TEX264, protein izražen u mnogim tkivima, uključujući kolorektalni rak, aktivira proces nukleofagije kako bi usmjerio nakupine do sustava za odlaganje otpada u stanici, lizosoma, gdje se razgrađuju i uništavaju, kaže se u objašnjenju rada. Proces je neophodan za popravak DNK i osiguravanje preživljavanja stanica, posebno tijekom teraprija za liječenje raka koje ciljaju na DNK, kao što su one koji se koriste u terapiji raka debelog crijeva. Vodeći autor na ovoj studiji je prof. dr. sc. Kristijan Ramadan, istaknuti naš znanstvenik s više zvanja od kojih se ističu biokemija i molekularna biologija. Prof. Ramadan nakon ETH u Zurichu došao na Oxford gdje je došao do titule redovnog profesora a sada svoje znanje prenosi na Tehničkom sveučilištu Nanyang u Singapuru.
Pitali smo prof. Ramadana kako je došlo do ovog otkrića koje je intrigantno jer poboljšava učinke postojećih terapija protiv raka. - Ovo je samo vrlo zanimljivo otkriće koje je pobudilo veliki interes znanstvene zajednice i koje pokazuje da je moguće poboljšati postojeću terapiju za karcinom debelog crijeva. Naše otkriće se bazira na 15-godišnjem radu moje znanstvene grupe koja se bavi otkrivanjem mehanizama oporavka oštećenja DNK molekula. Kako mnogi lijekovi za liječenje raka, kao i radioterapija, uništavaju DNK u stanicama i time dovode do smrti stanica ili zaustavljanju njihovog patološkog rasta, stanice raka se s vremenom adaptiraju na lijekove i često postanu otporne, pa čak i na zračenje i postanu sklone ubrzanom metastaziranju. Kada se dogodi ta rezistencija na terapiju, liječnici više nemaju izbora u liječenju raka. Tako da se moja grupa bavi traženjem mehanizama kako stanice raka razvijaju rezistenciju na radio-kemoterapiju. Stanični proces koji smo otkrili i opisali u našem znanstvenom radu (Lascaux et al. Cell, 2024) je samo nastavak našeg 15-godišnjeg rada, ali smo u zadnjih pet godina fokusirali naša istraživanja na terapiju kolorektalnog karcinoma, odnosno karcinoma debelog crijeva, zbog okruženja u kojem sam radio. Mi smo pronašli TEX264, specifični protein koji je opisan u procesu autofagije što je proces koji stanica aktivira kada nema energije ili kod gladovanja da oporavlja oštećenu DNK. To nam je bilo jako zanimljivo opažanje, i odlučili smo istraživati u tom smjeru i testirati našu hipotezu da li procesi autofagije direktno popravljaju oštećenu DNK nakon kemoterapije, kaže nam prof. Ramadan.
Nastavlja kako su rezultati samo fokusirani na ovu specifičnu publikaciju i dodatna istraživanja zahtijevana od recenzenata i znanstvene zajednice trajali pet godina. - Ali cijeli koncept ovog rada je samo jedan od proizvoda 15-godišnjeg rada moje znanstvene grupe. Uz to, na ovom radu je radilo oko 30-tak znanstvenika iz sedam različitih laboratorija iz Velike Britanije, SAD-a, Portugala, Hrvatske i Singapura. Tako da je ovo naše otkriće zajednički multinacionalni i multidisciplinarni produkt koji će potaknuti daljna istraživanja u ovom smjeru – autofagije i njezine uloge u terapiji raka. Jako mi je drago da su u ovom istraživanju, osim moje znanstvene grupe kao vodećeg tima, sudjelovale još dvije znanstvene grupe koje vode dvije naše vrhunske znanstvenice, Zagrepčanka dr. Marta Popović s Ruđer Bošković Instituta i Sinjanka prof. dr. Ira Milošević s instituta za genetiku u Oxfordu i Instituta za istraživanje procesa starenja u Portugalu, govori prof. Ramadan.
Nastavlja kako su rezultati samo fokusirani na ovu specifičnu publikaciju i dodatna istraživanja zahtijevana od recenzenata i znanstvene zajednice trajali pet godina. - Ali cijeli koncept ovog rada je samo jedan od proizvoda 15-godišnjeg rada moje znanstvene grupe. Uz to, na ovom radu je radilo oko 30-tak znanstvenika iz sedam različitih laboratorija iz Velike Britanije, SAD-a, Portugala, Hrvatske i Singapura. Tako da je ovo naše otkriće zajednički multinacionalni i multidisciplinarni produkt koji će potaknuti daljna istraživanja u ovom smjeru – autofagije i njezine uloge u terapiji raka. Jako mi je drago da su u ovom istraživanju, osim moje znanstvene grupe kao vodećeg tima, sudjelovale još dvije znanstvene grupe koje vode dvije naše vrhunske znanstvenice, Zagrepčanka dr. Marta Popović s Ruđer Bošković Instituta i Sinjanka prof. dr. Ira Milošević s instituta za genetiku u Oxfordu i Instituta za istraživanje procesa starenja u Portugalu, govori prof. Ramadan.
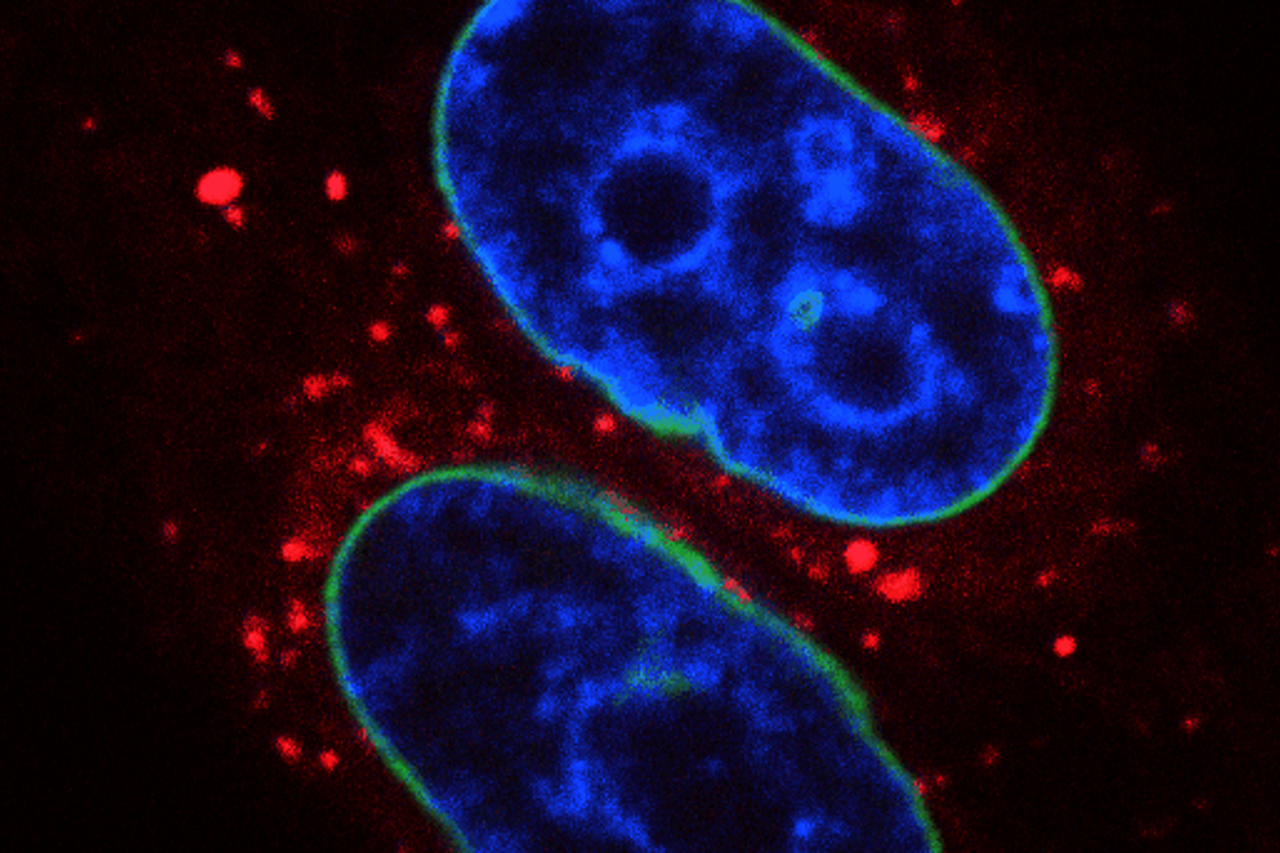
Dr. Marta Popović kaže kako nakon što je doktorandica Pauline sa kolegama u Oxfordu u istraživačkoj grupi dr. Ramadana pokazala da protein TEX264 omogućuje popravak DNK pomoću autofagije u ljudskim staničnim linijama koje se održavaju u kulturi u laboratoriju, željelo se ispitati da li je ovaj novi mehanizam DNA popravka prisutan i u živom organizmu, te da li je evolucijski sačuvan.
- U mojoj istraživačkoj grupi na IRB-u u sklopu Zavoda za istraživanje mora i okoliša, uspostavila sam pogon za male laboratorijske ribe zebrice (Danio rerio) u kojima proučavamo DNK popravak na razini organizma, a koristimo ih i kao model za razumijevanje ljudskih bolesti uključujući rak i neurodegenerativne bolesti (https://martafry.wixsite.com/popoviclab). Koristeći embrije riba zebrica, članovi mog tima, dr. Cecile Otten i dr. Ivan Antičević dokazali su da TEX264 povezuje put DNK popravka u staničnoj jezgri sa putem autofagije u citoplazmi stanice što vodi do popravka DNK oštećenja. Mjerenjem razine DNK popravka u embrijima zebrice pokazali smo da je TEX264 ključan protein za ovaj put popravka, što otvara vrata prema otkriću novih lijekova u terapiji tumora, govori.
Prof. Ramadan nastavlja kako su u suradnji s kliničarima koji su uključeni u klinička istraživanja kolorektalnog karcinoma u Velikoj Britaniji i bioinformatičarima koji su bili u mogućnosti analizirati veliki broj kliničkih podataka, došli do rezultata koji su potvrdili našu hipotezu i opažanje u laboratoriju. - Kako su znanstvenici vrlo skeptični kada se otkrije nešto novo, recenzenti našeg rada su tražili da naše otkriće provjerimo na životinjskom modelu i vidimo da li je to samo slučaj u kolorektalnom karcinomu ili generalni mehanizam kako se stanice brane od kemoterapije. Da bismo odgovorili na pitanja i kritike recenzenta, savjetovali smo se sa znanstvenom grupom dr. Marte Popović s Instituta Ruđer Bošković koja je naše otkriće neovisno potvrdila na ribe zebrice (Danio rerio). Kada je dr. Popović zajedno sa svojim timom potvrdila da je naše otkriće isto vidljivo u životinjskom modelu, znali smo da smo otkrili novi biološki proces koji će se moći dalje razvijati u terapiji karcinoma, i najvjerojatnije ne samo kolorektalnog karcinoma, opisuje. Objašnjeno nam je i zbog čega se koristila zebricaa ne uobičajeni laboratorijski miševi ili štakori. U usporedbi s mišem i štakorom koji se tradicionalno koriste za proučavanje puteva popravka oštećenja DNK, kancerogeneze i neurodegenerativnih bolesti, riba zebrica ima nekoliko komparativnih prednosti.
- Glavna prednost je vanjska oplodnja i vanjski razvoj embrija koji se mogu pratiti pod mikroskopom, komparativno jednostavnije utišavanje i inaktivacija gena pomoću CRISPR/Cas, velik broj jaja po leglu što omogućuje točnije, statistički značajnije i biološki relevantnije analize, i jeftinije i lakše održavanje u malom prostoru. Jednako važno, zebrica je jedini kralježnjak čiji je genom sekvencioniran i složen u sličnoj kvaliteti kao genom ljudi i miševa, geni uključeni u putove popravka DNK očuvani su 99 %, a 84 % gena za koje se zna da su povezani s ljudskim bolestima imaju ortologe kod zebrica. Molekularni mehanizmi, razvoj stanica i fiziologija organa uključujući srce, bubreg, jetru, gušteraču, crijevni trakt, mozak i spolne žlijezde slični su kao kod ljudi, a zebrica se koristi kao model za proučavanje raka, neurodegenerativnih, kardiovaskularnih, metaboličkih i drugih bolesti. Zamjena modela glodavaca zebricama u skladu je sa smjernicama EU komisije za korištenje životinjskih modela u znanstvenim istraživanjima i slijedi načelo 3R: Reduce, Replace, Refine, objasnila je dr. Popović.
Kako kaže prof. Ramadan značajno se povećava efikasnost standardne kemoterapije za karcinom debelog crijeva, ali je sada moguće i predvidjeti još jedan učinak liječenja.
- Terapija spominjana u našem otkriću je standardna terapija za karcinom debelog crijeva, ali je važno naglasiti da skoro svaki pacijent postane rezistentan na terapiju. Naše otkriće potvrđuje da na osnovu količine TEX264 proteina u stanicama raka debelog crijeva možemo predvidjeti kako će pacijenti odgovoriti na terapiju i produžiti efikasnost standardne terapije. Mi smo konkretno pokazali na 300-tinjak pacijenata da oni pacijenti koji imaju povećanu ekspresiju TEX264 proteina njihov odgovor na kemoterapiju je bolji za 50%. Uz to, naše otkriće pokazuje da kombinirana terapija korištenjem standardne terapije sa inhibitorima autofagije može poboljšati učinak terapije. Pronalaženje novih oblika terapije i biomarkera je esencijalno ako želimo poboljšati liječenje karcinoma debelog crijeva. Da se ne dobije krivi dojam kod čitatelja, ovo naše otkriće pokazuje novi potencijalni biomarker i mehanizam kako stanice raka odgovaraju na standardnu kemoterapiju i kako možemo poboljšati njenu efikasnost i identificirati za koje pacijente je najbolje koristiti određenu kemoterapiju. Međutim, da bi se naše otkriće primijenilo u praksi, moraju se prvo provesti randomizirana klinička ispitivanja gdje bi se dodatno potvrdilo da je moguće koristiti TEX264 protein kao biomarker za predikciju koja je terapija najefikasnija za određenog pacijenta (“personalized medicine”) i drugo, kako se može dozirati kombinacija inhibitora autofagije sa standardnom terapijom za kolorektalni karcinom da se poboljša terapeutski učinak i smanji pojava rezistencije na terapiju. Dobra je vijest što je jedan od inhibitora autofagije odobren za ljudsku upotrebu, ali bez direktnog kliničkog ispitivanja naše otkriće samo pokazuje mogućnost novih metoda u liječenju karcinoma, kaže prof. Ramadan.
On najavljuje i nastavak istraživanja za koji je dobio veliko povjerenje znanstvene institucije za koju sada radi.
- U tom smislu, nužno je naglasiti potrebu za daljnjim istraživanjima kako bismo dodatno potvrdili našu hipotezu o TEX264 proteinu i njegovoj ulozi u personaliziranoj medicini. Jedan od izazova u ovom području istraživanja je heterogenost tumora i individualni odgovor pacijenata na terapije. Razumijevanje molekularnih mehanizama u samom tumorskom tkivu je presudno za uspjeh personalizirane medicine i to će biti smjer moga budućeg istraživačkog rada. Zbog toga sam i pozvan da oformim centar za istraživanjetumora na medicinskom fakultetu Tehničkog sveučilišta Nanyang u Singapuru, koji mi je dao mogućnost da nastavim razvijati moje modele za ranu dijagnozu i terapiju tumora. Kako se naša znanstvena istraživanja nastavljaju u oba moja laboratoriju, u Oxfordu i u Singapuru, nadamo se da će naša buduća otkrića pridonijeti boljem razumijevanju rezistencije tumora i identificirati molekularne mehanizme na koje ćemo moći djelovati da bi uništili stanice raka, a sačuvali zdrave stanice. S obzirom na važnost pravovremene dijagnoze i liječenja, svaki korak prema razumijevanju i implementaciji naših otkrića može značajno utjecati na kvalitetu života pacijenata., govori nam naš znanstvenik.
Kaže da pošto suu otkrili da je proces autofagije vezan za oporavak oštećene DNK nakon kemoterapije, isto vidljiv u ribicama, paralelno su istraživali opisani proces u stanicama raka dojke s mutacijama u BRCA-genima, obliku genetskog i vrlo agresivnog karcinoma dojke. - Sličan proces smo našli i opisali i u karcinomu dojke, i upravo pripremam znanstveni rad da ga pošaljem na recenziju. Vidjet ćemo kako će recenzenti ocijeniti kvalitetu i rigoroznost naših eksperimenata na stanicama raka dojke, ali u svakom slučaju naša otkrića mi daju vjeru i snagu da nastavimo s našim radom kao potencijalnim novim oblikom kombinirane terapije za neke vrste tumora, a za sada kolorektalnog karcinoma i karcinoma dojke, kaže prof. Ramadan.